
La Unidad de Investigación Clínica del IDIBGI se crea con el fin de optimizar y promover la investigación clínica, tanto la que se promueve desde la industria farmacéutica como la realizada en la propia institución.
El objetivo es asesorar al investigador/a en la planificación de los proyectos tanto desde el punto de vista metodológico como regulatorio y apoyar su ejecución.
Por otra parte, también pretende ser una herramienta útil y transparente para los pacientes de forma que puedan saber en todo momento qué investigación se está llevando a cabo en nuestros centros y cómo participar en ellos.
Toda la investigación clínica que se lleva a cabo desde la Unidad de Investigación Clínica también debe tener la conformidad del CEIM o de la Oficina Tècnica de Recerca Clínica ICS/IAS:
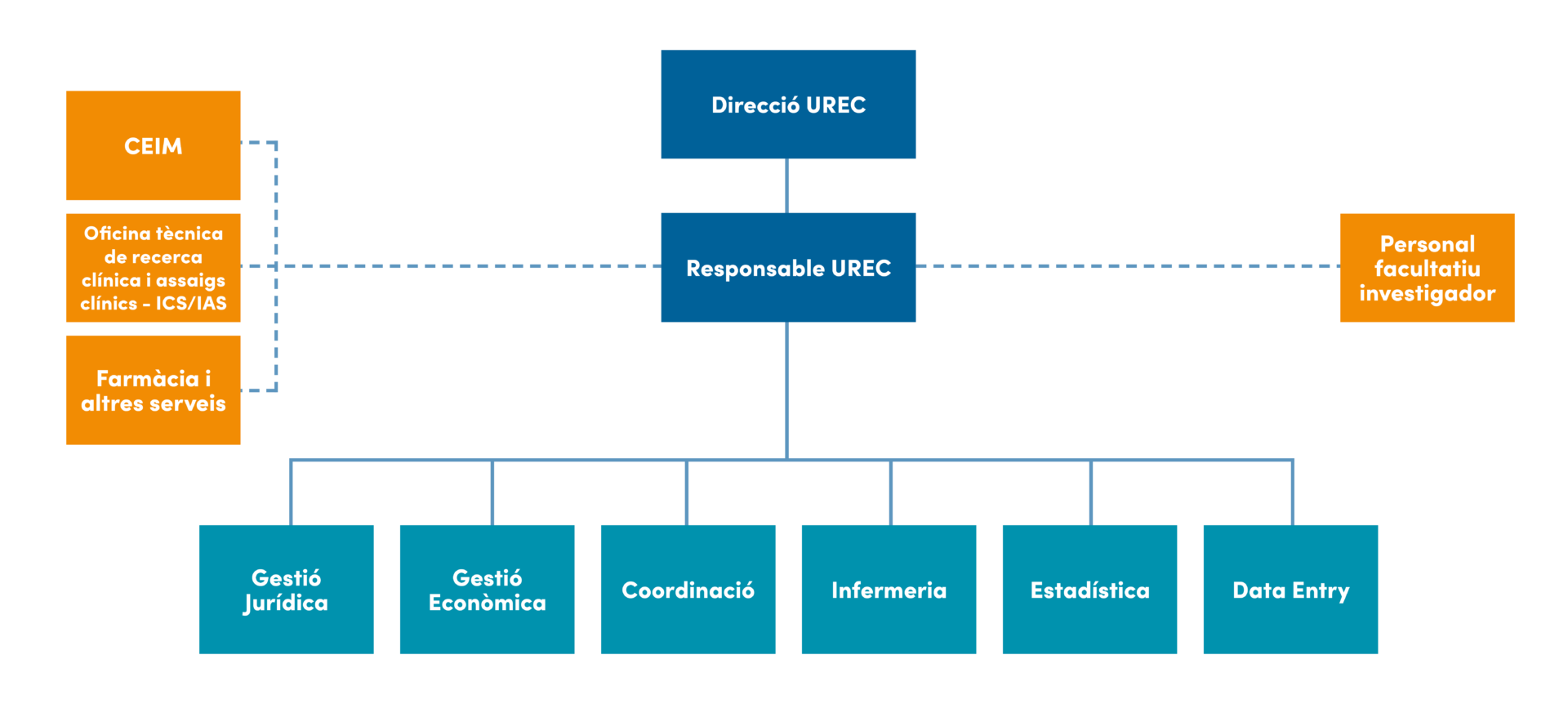
La Unidad de Investigación Clínica está formada actualmente por un Director Científico, una Responsable de la Unidad, coordinadores de ensayos clínicos, enfermería especializada y data entries. Este equipo es responsable de todas las actividades, desde la puesta en marcha de un estudio hasta su finalización, ofreciendo soporte de calidad para llegar a una investigación clínica de excelencia.
La participación en un proyecto de investigación generalmente la propone el profesional que está en contacto con el paciente.
A veces, según el tipo de estudio, es el paciente quien se puede ofrecer como respuesta a llamadas de participación vía anuncios o registros.
En los proyectos de investigación se establecen unos criterios que describen quién puede participar y quién no. Se denominan, respectivamente, criterios de inclusión y criterios de exclusión.
Los factores básicos que condicionan la participación en un estudio son, entre otros: edad, género, tipo de enfermedad, fase de la enfermedad, antecedentes de tratamiento anterior, otras condiciones médicas
En el caso de los ensayos clínicos con estos criterios se protege a los pacientes de recibir un tratamiento que podría perjudicarles, puesto que no todos los ensayos resultan apropiados para todos los pacientes. Un ensayo puede ser seguro para un paciente, pero no serlo para otro con el mismo diagnóstico.
El cumplimiento de la legalidad vigente y los procedimientos de trabajo que se siguen en el hospital aseguran un control adecuado y la dotación de los recursos necesarios para llevar a cabo las actividades de investigación, con los más altos niveles de compromiso con la calidad y la ética.
De acuerdo con los principios éticos que regulan la investigación, los participantes en estudios de investigación deben estar informados de qué consiste el estudio, los procedimientos a los que se someterán y los posibles riesgos.
Ello, en general, incluye una o más conversaciones entre el paciente y los investigadores
Tras recibir toda esta información, se le solicitará al paciente que lea y firme un documento de consentimiento informado conforme ha recibido esta información y todas sus dudas han sido resueltas.
La unidad quiere ofrecer apoyo regulatorio (ético y legal), apoyo metodológico y científico, y apoyo para la ejecución de la investigación clínica.
De acuerdo con los principios éticos que regulan la investigación, los participantes en estudios de investigación deben estar informados de qué consiste el estudio, los procedimientos a los que se someterán y los posibles riesgos.
Ello, en general, incluye una o más conversaciones entre el/la paciente y los/las investigadores/as
Tras recibir toda esta información, se le solicitará al/la paciente que lea y firme un documento de consentimiento informado conforme ha recibido esta información y todas sus dudas han sido resueltas.
Ir a la página de Investigación Clínica
